биотехнологии
Найдено: 10 записей
biotech →
Сэр, вот ваша печень: за кулисами биопечати
Попрощайтесь со списками доноров и нехваткой органов. Биотехнологическая фирма создала принтер, печатающий кровеносные сосуды, используя клетки пациента. В будущем это устройство имеет все шансы на создание целых органов.
«Сейчас мы хорошо справляемся с печатанием кровеносных сосудов», — говорит Бен Шэферд, старший научный исследователь в регенеративно-медицинской компании Organovo. «На этой неделе мы напечатали 10 штук. Мы продолжаем изучать, как можно улучшить состояние кровеносных сосудов, сделать из более крепкими.»
Большая часть органов в человеческом теле пронизана венами, так что способность печатать кровеносные сосуды является одним из важнейших структурных элементов для создания целых органов. Напечатанные вены скоро начнут проверять на животных, и, в конечном счёте, будут проведены клинические испытания на человеке. Если всё пройдёт хорошо, через несколько лет вы будете в состоянии заменить испорченные вены (например, в результате инъекций или химиотерапии) напечатанными по заказу венами из собственных клеток.

Печать целых органов упирается в проблемы не только технологического плана. Первая машина, печатающая органы, будет стоить сотни миллионов долларов — это с разработкой, тестированием, производством. И это не говоря о сложностях, с которыми придётся столкнуться любой компании при получении разрешения Управления по контролю за продуктами и лекарствами.
«Если Organovo сможет получить достаточно денег, у компании окажется возможность, чтобы преуспеть в качестве первой биопечатающей компании, но это покажет время», — говорит доктор Владимир Миронов, директор по развитию биопроизводства материи в Университете медицины в Южной Каролине.
Organovo показала Wired.com весь процесс печати кровеносных сосудов на изготовленном биопринтере.
Шэферд разместил биореактор внутри инкубатора, где кровеносные сосуды будут подавать насосом вместе со средой для выращивания несколько дней. В биореакторе используется специальная смесь химических веществ, идентичная той, с которой сталкиваются клетки, произрастая в организме — это помогает клеткам превратиться в крепкую сосудистую ткань.

Фотографии: Дэйв Баллок/Wired.com

Старший научный исследователь Бен Шэферд достаёт стволовые клетки из ванны с жидким азотом. До того, как клетки попадут в принтер, их культивируют до гораздо большего числа. В конечном счёте, эти клетки могут быть взяты из различных мест в организме пациента — жира, костного мозга, клеток кожи — и превращены в новые вены.

После того, как клетки разморозили, их культивируют в среде для выращивания (фото сверху). Это позволяет клеткам размножаться и расти так, чтобы их можно было использовать для построения вен. В этой среде также используются специальные химические продукты, которые «указывают» стволовым клеткам вырастать в необходимые типы клеток — в этом случае — в клетки кровеносных сосудов. Как только получается необходимое число клеток, они отделяются от среды для выращивания в центрифуге (фото снизу) и сжимаются в шарики.


Первый шаг во всём процессе печати — это покрытие материала под названием «гидрогель», который используется как временная подложка для поддержки ткани вены.
Разработанный принтер использует две насосные насадки, которые выбрызгивают или структуру подложки, или клетки в чашке Петри (прим. переводчика — лабораторная посуда в форме невысокого плоского цилиндра). Насосные насадки установлены на точном роботизированном сборочном устройстве для микроскопической аккуратности. На фотографии сверху насос справа погружается в контейнер с гидрогелем.

Камера, названная биореактором, служит для стимулирования вены — она подготавливается непосредственно перед печатью вены. Этот биореактор — довольно стандартная часть оборудования в биотехнологии. Он производится из алюминиевых блоков, которые окружены пластиковым контейнером с разнообразными отверстиями. Эти отверстия используются для нагнетания химических продуктов, которые будут питать растущую вену.

Перед печатью вен трубки культивированных клеток вручную загружаются в печатающую головку — это своеобразный картридж для принтера с биомассой.

Полоски гидрогеля выкладывают параллельно в лоток на чашке Петри. Затем цилиндры из клеточных шариков впечатывают в этот лоток. Ещё один цилиндр гидрогеля печатают посреди клеток, он необходим для создания отверстия внутри вены, по которому будет идти кровь (иллюстрация снизу).
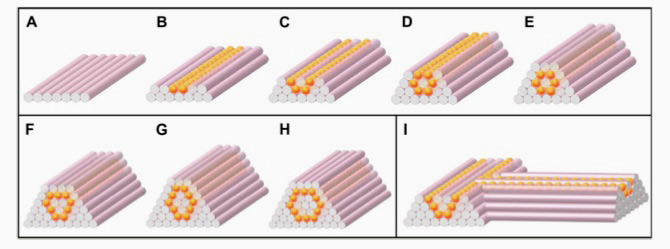
Иллюстрация любезно предоставлена компанией Organovo

Напечатанные вены выращивают в течение нескольких недель в другой среде для выращивания. Вскоре клетки освободят от гидрогеля, и в результате останутся полые трубки сосудистых клеток.

Напечатанные клетки в трубкообразной форме помещаются в биореактор. Биореактор (фото сверху) закачивает специальный коктейль протеинов, буферных растворов и других различных химических продуктов (фото снизу) сквозь напечатанную вену. Это идеальные условия для содержания клеток, делают вены крепкими и вообще очень хорошими.

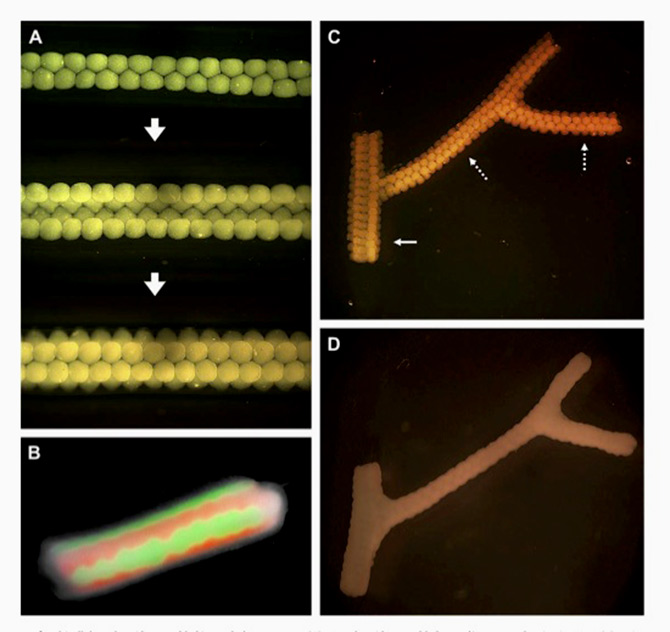
После пребывания в биореакторе, шарики клеток растут вместе, формируя вены, которые могут быть пересажены пациенту. Так как вены были выращены из собственных клеток пациентов, такие вены имеют больше шансов быть приняты организмом.
«Сейчас мы хорошо справляемся с печатанием кровеносных сосудов», — говорит Бен Шэферд, старший научный исследователь в регенеративно-медицинской компании Organovo. «На этой неделе мы напечатали 10 штук. Мы продолжаем изучать, как можно улучшить состояние кровеносных сосудов, сделать из более крепкими.»
Большая часть органов в человеческом теле пронизана венами, так что способность печатать кровеносные сосуды является одним из важнейших структурных элементов для создания целых органов. Напечатанные вены скоро начнут проверять на животных, и, в конечном счёте, будут проведены клинические испытания на человеке. Если всё пройдёт хорошо, через несколько лет вы будете в состоянии заменить испорченные вены (например, в результате инъекций или химиотерапии) напечатанными по заказу венами из собственных клеток.

Печать целых органов упирается в проблемы не только технологического плана. Первая машина, печатающая органы, будет стоить сотни миллионов долларов — это с разработкой, тестированием, производством. И это не говоря о сложностях, с которыми придётся столкнуться любой компании при получении разрешения Управления по контролю за продуктами и лекарствами.
«Если Organovo сможет получить достаточно денег, у компании окажется возможность, чтобы преуспеть в качестве первой биопечатающей компании, но это покажет время», — говорит доктор Владимир Миронов, директор по развитию биопроизводства материи в Университете медицины в Южной Каролине.
Organovo показала Wired.com весь процесс печати кровеносных сосудов на изготовленном биопринтере.
Биореактор
Шэферд разместил биореактор внутри инкубатора, где кровеносные сосуды будут подавать насосом вместе со средой для выращивания несколько дней. В биореакторе используется специальная смесь химических веществ, идентичная той, с которой сталкиваются клетки, произрастая в организме — это помогает клеткам превратиться в крепкую сосудистую ткань.

Фотографии: Дэйв Баллок/Wired.com

Стволовые клетки
Старший научный исследователь Бен Шэферд достаёт стволовые клетки из ванны с жидким азотом. До того, как клетки попадут в принтер, их культивируют до гораздо большего числа. В конечном счёте, эти клетки могут быть взяты из различных мест в организме пациента — жира, костного мозга, клеток кожи — и превращены в новые вены.

После того, как клетки разморозили, их культивируют в среде для выращивания (фото сверху). Это позволяет клеткам размножаться и расти так, чтобы их можно было использовать для построения вен. В этой среде также используются специальные химические продукты, которые «указывают» стволовым клеткам вырастать в необходимые типы клеток — в этом случае — в клетки кровеносных сосудов. Как только получается необходимое число клеток, они отделяются от среды для выращивания в центрифуге (фото снизу) и сжимаются в шарики.


Гидрогелевая подложка
Первый шаг во всём процессе печати — это покрытие материала под названием «гидрогель», который используется как временная подложка для поддержки ткани вены.
Разработанный принтер использует две насосные насадки, которые выбрызгивают или структуру подложки, или клетки в чашке Петри (прим. переводчика — лабораторная посуда в форме невысокого плоского цилиндра). Насосные насадки установлены на точном роботизированном сборочном устройстве для микроскопической аккуратности. На фотографии сверху насос справа погружается в контейнер с гидрогелем.

Камера, названная биореактором, служит для стимулирования вены — она подготавливается непосредственно перед печатью вены. Этот биореактор — довольно стандартная часть оборудования в биотехнологии. Он производится из алюминиевых блоков, которые окружены пластиковым контейнером с разнообразными отверстиями. Эти отверстия используются для нагнетания химических продуктов, которые будут питать растущую вену.

Перед печатью вен трубки культивированных клеток вручную загружаются в печатающую головку — это своеобразный картридж для принтера с биомассой.

Гидрогелевая заливочная форма для кровеносных сосудов
Полоски гидрогеля выкладывают параллельно в лоток на чашке Петри. Затем цилиндры из клеточных шариков впечатывают в этот лоток. Ещё один цилиндр гидрогеля печатают посреди клеток, он необходим для создания отверстия внутри вены, по которому будет идти кровь (иллюстрация снизу).

Иллюстрация любезно предоставлена компанией Organovo

Выращивание вен
Напечатанные вены выращивают в течение нескольких недель в другой среде для выращивания. Вскоре клетки освободят от гидрогеля, и в результате останутся полые трубки сосудистых клеток.

Очень хорошие вены
Напечатанные клетки в трубкообразной форме помещаются в биореактор. Биореактор (фото сверху) закачивает специальный коктейль протеинов, буферных растворов и других различных химических продуктов (фото снизу) сквозь напечатанную вену. Это идеальные условия для содержания клеток, делают вены крепкими и вообще очень хорошими.


Готовый продукт
После пребывания в биореакторе, шарики клеток растут вместе, формируя вены, которые могут быть пересажены пациенту. Так как вены были выращены из собственных клеток пациентов, такие вены имеют больше шансов быть приняты организмом.
13.07.2010 10:17+0400
Научно популярное →
Синтетическая жизнь от Крейга Вентера
Я не специалист в биологии, и когда поднялась шумиха вокруг синтетической клетки Крейга Вентера, сразу не мог понять в чем соль. Давно уже известно, что геномо-инженеры кромсают бедные гены как хотят, и делают новые организмы с заранее заданными свойствами и т.д. Захотелось разобраться и понять, что же там действительно нового. Посмотрел, что об этом есть в сети. И вот, что на мой поверхностный взгляд, кажется, понял. Суть в том, что ранее всегда за исходный материал брались генный материал, синтезированный живыми клетками и над ними производились манипуляции. А теперь все манипуляции проводятся не с биологическим материалом в пробирке, а с записанным в компьютере и заранее расшифрованным, генетическим кодом. Таким образом главная задача состоит в том, чтобы сконструировать по заданной (и даже отредактированной по желанию программиста-биолога или даже программой) в компьютере последовательности ДНК реальную хромосому из отдельных нуклеиновых оснований (т.е. буквально из четырех банок с четырьмя исходными веществами) и активировать ее в клетке-реципиенте. Биологи, поправьте, если что не так.
03.06.2010 13:51+0400
biotech →
Иммунная система человека: биологический антивирус. Антивирусные базы
Прошу простить за нереально огромный перерыв после первой части :(
Линк на первую часть (врожденный иммунитет)
Итак, нечто, проникшее в организм, было признано враждебным и уничтожено. Но каждый раз определять посторонние сущности по общим неспецифичным признакам — далеко не оптимальная концепция поведения, так как патогены могут выработать систему маскировки, которая предотвратит их обнаружение. Для того, чтобы обнаруживать этих микроорганизмов (а также увеличить эффективность реагирования по отношению ко всем остальным), возникла специфичная (она же приобретенная) иммунная система, которая включает в себя T-лимфоциты и B-лимфоциты, производящие антитела.
Линк на первую часть (врожденный иммунитет)
Итак, нечто, проникшее в организм, было признано враждебным и уничтожено. Но каждый раз определять посторонние сущности по общим неспецифичным признакам — далеко не оптимальная концепция поведения, так как патогены могут выработать систему маскировки, которая предотвратит их обнаружение. Для того, чтобы обнаруживать этих микроорганизмов (а также увеличить эффективность реагирования по отношению ко всем остальным), возникла специфичная (она же приобретенная) иммунная система, которая включает в себя T-лимфоциты и B-лимфоциты, производящие антитела.
26.02.2010 05:03+0300
biotech →
Мобильные телефоны защищают от болезни Альцгеймера
Многие годы ученые пытаются выявить зависимости между использование телефона и раком головного мозга. Недавно, эти исследования привели к необычным результатом. У мышей, с предрасположенностью к болезни Альцгеймера, облучение волнами, аналогичными волнам от телефона, привело к уменьшению вероятности развития этого заболевания. Так что, много говорить по мобильному телефону, может быть даже и полезно.
Про этом можно прочитать больше здесь (на английском языке).
По русски, можно прочитать здесь
Про этом можно прочитать больше здесь (на английском языке).
По русски, можно прочитать здесь
10.01.2010 21:43+0300
biotech →
Иммунная система человека: биологический антивирус. Эвристические алгоритмы
Доброе время суток, уважаемое хабра-сообщество!
Это мой первый пост на Хабре, так что очень вас прошу, не судите слишком строго.
Я полагаю, все вы видели многочисленные рекламные ролики про уязвимый иммунитет, и все помнят школьные уроки, на которых рассказывалось про фагоцитов, пожирающих бактерий. Однако иммунная система организма — это сложнейший механизм, призванный оградить хозяина от любой опасности. А опасности могут быть очень разными. Я хотел бы попытаться рассказать о том, как иммунная система обнаруживает эти опасности, как она с ними борется, и как все это можно регулировать и использовать.
Это мой первый пост на Хабре, так что очень вас прошу, не судите слишком строго.
Я полагаю, все вы видели многочисленные рекламные ролики про уязвимый иммунитет, и все помнят школьные уроки, на которых рассказывалось про фагоцитов, пожирающих бактерий. Однако иммунная система организма — это сложнейший механизм, призванный оградить хозяина от любой опасности. А опасности могут быть очень разными. Я хотел бы попытаться рассказать о том, как иммунная система обнаруживает эти опасности, как она с ними борется, и как все это можно регулировать и использовать.
16.11.2009 19:07+0300
biotech →
3D-модель рибосомы на атомном уровне
Нобелевская премия 2009 по химии
Исследования функций и структуры рибосом.
Венкатраман Рамакришнан (Venkatraman Ramakrishnan), США; Томас Стейц (Thomas Steitz), США; Ада Йонат (Ada Yonath), Израиль.
Как известно, структура любого организма запрограммирована изначально в генетическом коде и сохраняется в ДНК. По этой программе (после её копирования в РНК) происходит производство каждой молекулы нашего организма. Непосредственно компиляцией протеинов занимаются рибосомы — своеобразные роботизированные мини-фабрики, которые присутствуют в каждой клетке. До XXI века наука не знала подробностей этого процесса, но он стал гораздо понятнее благодаря работе, которую нынешние нобелевские лауреаты практически параллельно выполнили и опубликовали в 2000 году. Они в малейших деталях засняли рибосому с помощью крио-электронного микроскопа и составили функциональную 3D-карту этого органоида. За что и получили Нобелевскую премию по химии 2009 года.

08.10.2009 15:16+0400
biotech →
Генная инженерия от A до Z часть 3
Краткое содержание предыдущих серий:
Ученые открыли ген синего свечения. Мы прочитали об этом гене загорелись сделать светящуюся трансгенную елку. Нашли в специализированных ресурсах его название и последовательность, выбили командировку у шефа и скатались туда, где живет животное – бутявка, в которой содержится этот ген.
Путем различных ухищрений с применением специального оборудования мы получили чистые молекулы ДНК гена bl1.
К этим молекулам ДНК навесили служебные последовательности для работы внутри клетки, и создали трансгенные бактерии E.coli на их основе.
Ученые открыли ген синего свечения. Мы прочитали об этом гене загорелись сделать светящуюся трансгенную елку. Нашли в специализированных ресурсах его название и последовательность, выбили командировку у шефа и скатались туда, где живет животное – бутявка, в которой содержится этот ген.
Путем различных ухищрений с применением специального оборудования мы получили чистые молекулы ДНК гена bl1.
К этим молекулам ДНК навесили служебные последовательности для работы внутри клетки, и создали трансгенные бактерии E.coli на их основе.
25.02.2009 15:36+0300
biotech →
Генная инженерия от A до Z часть 2
Итак, настало время продолжения статьи о том, как все же сделать светящуюся елку к следующему новому году с применением настоящей генной инженерии, а не той, о которой вы до этого могли прочитать в новостях :)
Краткое содержание предыдущей серии:
Ученые открыли ген синего свечения. Мы прочитали об этом гене и загорелись сделать светящуюся трансгенную елку. Нашли в специализированных ресурсах его название и последовательность, выбили командировку у шефа и скатались туда, где живет животное – бутявка, в которой содержится этот ген.
Путем различных ухищрений с применением специального оборудования мы получили чистые молекулы ДНК гена bl1, кодирующего белок синего свечения.
У нас есть ген. Чего же мы ждем, спросят читатели, давайте засунем этот ген в елку и она начнет светиться?
Не все так просто, и вот, почему.
Краткое содержание предыдущей серии:
Ученые открыли ген синего свечения. Мы прочитали об этом гене и загорелись сделать светящуюся трансгенную елку. Нашли в специализированных ресурсах его название и последовательность, выбили командировку у шефа и скатались туда, где живет животное – бутявка, в которой содержится этот ген.
Путем различных ухищрений с применением специального оборудования мы получили чистые молекулы ДНК гена bl1, кодирующего белок синего свечения.
У нас есть ген. Чего же мы ждем, спросят читатели, давайте засунем этот ген в елку и она начнет светиться?
Не все так просто, и вот, почему.
12.01.2009 00:42+0300
biotech →
Генная инженерия от A до Z
Приветствую уважаемое сообщество!
Итак, это мой первый пост на хабре :)
Посвящен он будет серьезной теме, в которой, волею судеб, я неплохо разбираюсь. А именно, генной инженерии.
Помнится, тут пробегал пост в котором говорилось о геннотехнологической лаборатории “на коленке”. Оказалось, что тема интересна аудитории, поэтому я решил заняться ее развитием с просветительскими целями.
Я буду давать наглядные и понятные обычным людям примеры для описания сложных процессов. Если кто-то посчитает нужным меня поправить – не стесняйтесь. Я буду сознательно упускать многие вещи, но если вам кажется, что без них страдает логика изложения – так же поправляйте.
Итак, это мой первый пост на хабре :)
Посвящен он будет серьезной теме, в которой, волею судеб, я неплохо разбираюсь. А именно, генной инженерии.
Помнится, тут пробегал пост в котором говорилось о геннотехнологической лаборатории “на коленке”. Оказалось, что тема интересна аудитории, поэтому я решил заняться ее развитием с просветительскими целями.
Я буду давать наглядные и понятные обычным людям примеры для описания сложных процессов. Если кто-то посчитает нужным меня поправить – не стесняйтесь. Я буду сознательно упускать многие вещи, но если вам кажется, что без них страдает логика изложения – так же поправляйте.
07.01.2009 21:32+0300
biotech →
Доктор Вентер пытается запатентовать синтетическую бактерию
Знаменитый генетик Крейг Вентер, который уже много лет работает над проблемой синтеза жизни, решился-таки запатентовать метод и набор ключевых генов, которые можно использовать для получения синтетических микроорганизмов, способных самостоятельно расти и размножаться.
Заслуга доктора в том, что он провёл изыскания и определил минимальный набор генов, необходимый для размножения бактерии. Именно этот набор Вентер пытается запатентовать, что вызвало шквал критики со стороны коллег по цеху. Они говорят, что коммерциализация генетики может привести к приватизации живых существ.
Группа учёных под руководством доктора Вентера поставила задачу определить, какие именно гены являются критически необходимыми для размножения бактерии Mycoplasma genitalium. Для этого они взяли бактерию и начали удалять гены один за другим, сохраняя её живой. Из 482 генов удалось удалить 101. Таким образом, оставшиеся гены (381) признаны «минимальным набором жизни». Доктор Вентер хочет запатентовать способ синтеза живых организмов на базе этого набора. Специально для коммерческой деятельности доктор основал корпорацию «Синтетическая геномика».
Учёные из общественной организации ETC Group готовы пойти на всё, чтобы доктор не получил этот патент. Они считают, что этот патент положит начало к появлению копирайта на формы жизни. На нашей планете появятся живые существа, которые будут являться интеллектуальной собственностью человека или корпорации.
Правильно запрограммированные, эти микроорганизмы, например, могут синтезировать этанол прямо в стакане для рюмке или водород прямо в топливном баке автомобиля. Они могут устранить излишек углекислого газа в атмосфере и очистить океан от нефтяных пятен. Такие бактерии являются решением многих ключевых проблем человечества, и именно поэтому нельзя допустить, чтобы они находились в чьей-либо собственности.
«Мы не хотим разрабатывать долговременную стратегию юридической борьбы, чтобы отбраковывать плохие патенты, — сказал представитель ETC Group. — Эти патенты должны отвергаться ещё до того, как они публикуются».
via BBC
Заслуга доктора в том, что он провёл изыскания и определил минимальный набор генов, необходимый для размножения бактерии. Именно этот набор Вентер пытается запатентовать, что вызвало шквал критики со стороны коллег по цеху. Они говорят, что коммерциализация генетики может привести к приватизации живых существ.
Группа учёных под руководством доктора Вентера поставила задачу определить, какие именно гены являются критически необходимыми для размножения бактерии Mycoplasma genitalium. Для этого они взяли бактерию и начали удалять гены один за другим, сохраняя её живой. Из 482 генов удалось удалить 101. Таким образом, оставшиеся гены (381) признаны «минимальным набором жизни». Доктор Вентер хочет запатентовать способ синтеза живых организмов на базе этого набора. Специально для коммерческой деятельности доктор основал корпорацию «Синтетическая геномика».
Учёные из общественной организации ETC Group готовы пойти на всё, чтобы доктор не получил этот патент. Они считают, что этот патент положит начало к появлению копирайта на формы жизни. На нашей планете появятся живые существа, которые будут являться интеллектуальной собственностью человека или корпорации.
Правильно запрограммированные, эти микроорганизмы, например, могут синтезировать этанол прямо в стакане для рюмке или водород прямо в топливном баке автомобиля. Они могут устранить излишек углекислого газа в атмосфере и очистить океан от нефтяных пятен. Такие бактерии являются решением многих ключевых проблем человечества, и именно поэтому нельзя допустить, чтобы они находились в чьей-либо собственности.
«Мы не хотим разрабатывать долговременную стратегию юридической борьбы, чтобы отбраковывать плохие патенты, — сказал представитель ETC Group. — Эти патенты должны отвергаться ещё до того, как они публикуются».
via BBC
15.06.2007 19:43+0400
